Почему при заполении электронных оболочек атомов элементов 4-го периода сначала заполняется 4s, а затем 3d подуровень?
Циклы электронной конфигурации атомов элементов, включающие в себя последовательности заполнения электронных оболочек, вносят определенный порядок и стабильность во вселенную атомов. В периодической системе элементов, 4-й период – это особый случай, когда сначала заполняется 4s подуровень, а затем 3d подуровень. Почему так происходит, и какой физический закон определяет эту последовательность?
По сути, порядок заполнения электронных подуровней определяется энергией и принципами электронного строения атомов, которые включают в себя принципы минимизации энергии и принцип Ausschluss (исключение Паули). Эти принципы играют важную роль в формировании структуры атомов и определяют последовательность заполнения электронных подуровней.
В периодической системе элементов, каждый элемент имеет определенное количество электронов и энергию этих электронов. При заполнении электронных оболочек атома, электроны стремятся занять подуровни с наименьшей энергией. Подуровень с меньшей энергией заполняется первым, а затем переходит к следующему. Этот процесс продолжается до тех пор, пока все электроны не будут распределены по подуровням и оболочкам.
Почему атомы элементов 4 го периода сначала заполняют 4s подуровень, а потом 3d подуровень
Распределение электронов в атомах элементов осуществляется в соответствии с принципами электронной конфигурации. В теории электронной структуры атомов, существует правило, называемое правилом энергетического приоритета, объясняющее, почему атомы элементов 4-го периода сначала заполняют 4s подуровень и только затем 3d подуровень.
Первое, что необходимо понять, это то, что элементы внутри периода имеют одинаковую главную энергию, поскольку они расположены на одном и том же уровне. Внешние электроны, которые находятся в 4с- и 3d-подуровнях, имеют близкие энергии, но их порядок заполнения может быть отличным.
Сначала заполняется 4s подуровень, так как у него более низкая энергия, чем 3d подуровень. Это происходит из-за эффекта экранирования ядра другими электронами. Электроны 4s-подуровня находятся ближе к ядру и их энергия ощущается сильнее, в то время как 3d-подуровень находится дальше от ядра и его энергия слабее замечается. В результате, 4s-подуровень заполняется первым.
После заполнения 4s подуровня, заполняется 3d подуровень, который обладает более высокой энергией. Как только 3d-подуровень заполняется, энергия его электронов снижается, так как они приобретают выгоду от большей экранировки оставшимися электронами на 4s-подуровне. Этот феномен объясняет, почему 4s подуровень заполняется первым, а затем заполняется 3d подуровень.
Таким образом, в атомах элементов 4-го периода, заполнение 4s подуровня перед заполнением 3d подуровня объясняется энергетическим приоритетом электронов и их влиянием на взаимодействие с ядром.
Распределение электронов в атоме элемента
В атомах элементов 4-го периода (периоды в периодической системе химических элементов указывают на количество энергетических уровней в атоме) сначала заполняется 4s подуровень, а затем 3d подуровень. Ответ на вопрос о порядке заполнения электронами этих подуровней связан с их энергией.
Подуровни электронной оболочки атома имеют различную энергию. В атомах элементов 4-го периода энергия 3d подуровня выше, чем энергия 4s подуровня. Поэтому, при заполнении атома электронами, сначала заполняется подуровень 4s, а только потом — 3d.
Это объясняется тем, что электроны стремятся занимать низкоэнергетические уровни наиболее близкими к ядру. Так как уровень 4s ближе к ядру, чем 3d, то он заполняется раньше.
Однако, при заполнении подуровней f и d, энергии подуровней могут перекрываться, и порядок заполнения может отличаться от основного правила заполнения электронов по возрастанию энергии подуровней.
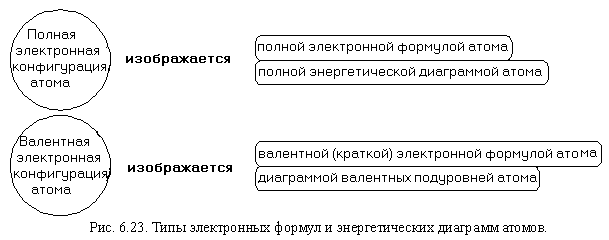
Принцип заполнения электронных оболочек
Принцип заполнения электронных оболочек основан на наблюдении, что атомы наделяются электронами по определенным правилам. Эти правила были сформулированы в Хундовских правилах и правиле Клейдона. Согласно этим правилам, электроны заполняют электронные оболочки один за другим, начиная с наименьших энергетических уровней.
В периодической системе элементы располагаются по возрастанию атомной номера. В атомах элементов 4-го периода, например, сначала заполняется 4s-подуровень, а затем 3d-подуровень. Это объясняется тем, что энергетический уровень 4s находится ближе к ядру и имеет более низкую энергию, чем 3d. Поэтому на него электроны попадают в первую очередь. Заполнение 4s-подуровня происходит до заполнения 3d-подуровня, потому что согласно правилу Клейдона, электроны будут стремиться максимально заполнить подуровни с наименьшей энергией, перед тем как переходить к подуровням с более высокой энергией.
Таким образом, принцип заполнения электронных оболочек учитывает энергетический уровень и порядок подуровней, определяя последовательность заполнения электронами. Этот принцип играет важную роль в определении химических свойств элементов и их взаимодействия с другими веществами.
Правило Клечковского
В химии существует правило, называемое правилом Клечковского, которое объясняет порядок заполнения энергетических уровней электронами в атомах элементов 4-го периода. Согласно данному правилу, сначала заполняется 4s-подуровень, а затем 3d-подуровень.
Это правило основано на энергетических уровнях и подуровнях электронов в атоме. Электроны в атоме распределены по энергетическим уровням и подуровням, принимая наименьшую энергию возможного состояния. В периодической системе элементов, атомы, в которых сначала заполняется 4s-подуровень, а затем 3d-подуровень, находятся в 4-м периоде, так как текущий уровень переходит с 3-го на 4-й.
Это объяснение основывается на энергетической структуре атома. 4s-подуровень имеет более низкую энергию, чем 3d-подуровень, поэтому сначала он будет заполнен, а затем 3d-подуровень. Это связано с распределением электронов в атоме, так как энергия и электронная конфигурация играют роль в определении порядка заполнения энергетических уровней.
Экспериментальные исследования и теоретические расчеты позволяют установить правило Клечковского для элементов 4-го периода. Это правило также предсказывает порядок заполнения для других периодов в периодической системе элементов. Правило Клечковского является одним из многих правил и закономерностей, которые объясняют атомную структуру элементов и их химические свойства.
Основные подуровни электронных оболочек
Электронные оболочки атомов элементов состоят из подуровней, на которых располагаются электроны. Подуровни обозначаются буквами: s, p, d и f. Они различаются по форме и энергии, что определяет порядок заполнения.
В атомах элементов 4-го периода первым заполняется подуровень 4s, а затем подуровень 3d. Это связано с различием в энергиях подуровней.
Подуровень 4s имеет более низкую энергию, чем подуровень 3d, поэтому электроны заполняют его в первую очередь. Когда 4s-подуровень полностью заполнен, начинается заполнение 3d-подуровня.
Такой порядок заполнения подуровней объясняется электронной конфигурацией атома. Атом стремится достичь наиболее стабильного состояния, имея заполненную внешнюю оболочку, что достигается путем заполнения подуровней с более низкой энергией.
Заполнение подуровней происходит в соответствии с принципом неопределенности Хайзенберга и правилом Клечковского. Согласно этим правилам, каждый подуровень может содержать определенное количество электронов, а электроны находятся в оболочках наиболее низкой энергии.
| Подуровень | Форма | Максимальная вместимость |
|---|---|---|
| 1s | s | 2 |
| 2s | s | 2 |
| 2p | p | 6 |
| 3s | s | 2 |
| 3p | p | 6 |
| 4s | s | 2 |
| 3d | d | 10 |
| 4p | p | 6 |
Таблица показывает формы подуровней и их максимальную вместимость. Подуровни s и p могут содержать до 2 и 6 электронов соответственно. Но подуровень d имеет максимальную вместимость 10 электронов.
Таким образом, порядок заполнения подуровней в атомах элементов 4-го периода обусловлен энергетическими характеристиками подуровней и стремлением атому к наиболее стабильному состоянию.
Подуровень 4s
В атомах элементов 4-го периода в электронных оболочках сначала заполняется подуровень 4s, а затем уже 3d. Это связано с энергетическими уровнями этих подуровней и порядком заполнения электронами.
Подуровень 4s расположен на более низком энергетическом уровне, чем подуровень 3d. Это означает, что электроны в атоме имеют более низкую энергию и более стабильное положение на подуровне 4s. Заполнение подуровня 4s происходит до заполнения 3d подуровня, чтобы максимально уменьшить энергетическую потенциальную энергию системы атома.
| Порядок заполнения электронами | Подуровень |
|---|---|
| 1 | 4s |
| 2 | 3d |
Такое порядок заполнения электронами объясняется особенностями расположения энергетических уровней в атомах и взаимодействием электронов внутри атома. Это явление называется правилом строения электронных оболочек и определено энергией подуровней.
Подуровень 3d
Получив благодаря электронному конфигурационному принципу (принципу Максвелла) полную занятость электронами внешней s-оболочки, атомы начинают заполнять электроны в более высокоэнергетический подуровень 3d. Это объясняется тем, что электроны находятся на более энергетически высоких орбиталях и могут обладать большей максимальной энергией.
При заполнении 4s-подуровня, возможно получение симметричных, энергетически низких блоков, которые очень стабильны и обладают свойством заполнения. Это смягчает энергию 3d-электронов внутренней оболочки и уменьшает их энергетическую разницу.
Электроны сначала заполняют s-оболочку для достижения наиболее стабильной конфигурации. Затем происходит заполнение d-оболочки с увеличением энергии. Такой порядок заполнения обусловлен энергетическими и квантовыми характеристиками d- и s-орбиталей и позволяет достичь наиболее энергетически выгодной конфигурации атома.
Окончание заполнения подуровня 3d обозначает окончание заполнения d-подуровней в атомах элементов 4-го периода.
Почему сначала заполняется 4s, а потом 3d подуровень
Порядок заполнения электронов в атомах элементов определяется на основе энергетического уровня электронов и принципа минимальной энергии. Периодическая система элементов может помочь нам понять, почему сначала заполняется 4s, а потом 3d подуровень.
Периодическая система элементов состоит из горизонтальных строк, называемых периодами, и вертикальных столбцов, называемых группами. В каждом периоде энергетические уровни электронов заполняются по возрастанию. Помимо этого, уровни энергии делятся на подуровни, обозначаемые буквами s, p, d, f. Каждый подуровень имеет различную энергию и может содержать ограниченное количество электронов.
В атомах элементов 4-го периода, сначала заполняется 4s подуровень, а затем 3d подуровень. На первый взгляд, это может показаться необычным, так как уровень 3d находится на более низкой энергии, чем 4s. Однако, чтобы понять этот факт, нужно обратиться к конфигурации энергетических уровней и принципу минимальной энергии.
Уровни энергии электронов заполняются в соответствии с набором правил, известных как правило Клечковского (или правило энергетического уровня). Согласно этому правилу, на каждый подуровень следует заполнять сначала недостающие электроны с нижнего уровня. Другими словами, атом стремится достичь минимальной энергии за счет заполнения подуровней по порядку возрастания их энергии.
В случае 4-го периода элементов, уровень 4s имеет более низкую энергию, чем уровень 3d. Таким образом, заполнение 4s подуровня следует сначала, чтобы достигнуть минимальной энергии. Затем, после заполнения 4s подуровня, переходим к заполнению 3d подуровня, поскольку он имеет более высокую энергию.
Элементы периода имеют похожую энергетику, поэтому при наличии свободного пространства в 4s подуровне, атомы элементов 4-го периода заполняют его в первую очередь, перед переходом к заполнению 3d подуровня.
Таким образом, порядок заполняемых подуровней в атомах элементов 4-го периода определяется энергетическим уровнем подуровней и принципом минимальной энергии, согласно которому 4s подуровень заполняется сначала, а затем заполняется 3d подуровень.
Уровень энергии подуровней
Таблица ниже демонстрирует порядок заполнения подуровней с учетом уровня энергии:
| Подуровень | Уровень энергии |
|---|---|
| 4s | 1 |
| 3d | 2 |
| 4p | 3 |
| 5s | 4 |
| 4d | 5 |
| 5p | 6 |
| 6s | 7 |
Подуровни в атомах заполняются в соответствии с так называемым правилом Клейна-Гордона. Согласно этому правилу, подуровни заполняются в порядке возрастания их энергии. Поскольку уровень энергии 4s подуровня ниже, чем уровень энергии 3d подуровня, то электроны сначала заполняют 4s подуровень, а затем 3d подуровень.
Вопрос-ответ:
Почему в атомах элементов 4 го периода сначала заполняется 4s подуровень перед 3d подуровнем?
Это происходит из-за различий в энергетических уровнях и количестве электронов на каждом подуровне. Подуровень 4s имеет более низкую энергию, чем 3d, и получает электроны в первую очередь. Это связано с электронной конфигурацией и принципом заполнения подуровней.
Каким образом происходит заполнение подуровней 4s и 3d в атомах элементов 4 го периода?
Заполнение происходит по принципу заполнения подуровней. Сначала заполняется 4s подуровень, так как он имеет меньшую энергию и может вместить максимум 2 электрона. Затем заполняется 3d подуровень, который имеет более высокую энергию и может вместить до 10 электронов.
Почему 4s подуровень имеет меньшую энергию, чем 3d подуровень в атомах элементов 4 го периода?
Энергетические уровни подуровней зависят от эффективности экранирования электронами других подуровней и ядерного заряда. Более близкий к ядру 4s подуровень экранируется лучше от других подуровней и имеет меньшую энергию, чем 3d подуровень, который находится дальше от ядра и имеет меньшую степень экранирования.
Каково значение принципа заполнения подуровней в атомах элементов 4 го периода?
Принцип заполнения подуровней устанавливает правило заполнения электронами подуровней с наименьшей энергией. В атомах элементов 4 го периода этот принцип означает, что сначала заполняется 4s подуровень, который имеет меньшую энергию, перед заполнением 3d подуровня, который имеет более высокую энергию.
Может ли порядок заполнения подуровней быть изменен в атомах элементов 4 го периода?
Нет, порядок заполнения подуровней не может быть изменен в атомах элементов 4 го периода. Это обусловлено энергетическими уровнями подуровней и принципом заполнения подуровней, который требует заполнения подуровня с наименьшей энергией перед заполнением подуровня с более высокой энергией.